مواد اطراف ما هرکدام از ترکیب اتم های خاصی بوجود آمده اند . آیا تابحال از خود پرسیده اید چرا اگر نوع ترکیب اتم ها باهم عوض شود نوع ماده هم عوض می شود؟ یا ترکیبات یونی چگونه بوجود می آیند و یا چگونه اتم ها با ترکیب باهمدیگر گازها ، جامد ها و مایع ها را بوجود می آورند.
می دانیم که مجموعه اتم ها کنارهم مولکول را بوجود می آوردند و مولکول در دو نوع عنصر و ترکیب وجود دارد.(در صورت عنصر است که اتم های بهم متصل شده از یک نوع باشند و در صورتی ترکیب است که اتم های بهم متصل شده از یک نوع نباشند.)
ترکیبات :
ترکیب مولکول ها با هم در دو نوع وجود دارد : ترکیبات یونی و ترکیبات مولکولی.
- ترکیب یونی : در این ترکیب اتم ها با هم مبادله ی الکترون دارند (باهم الکترون جابجا می کنند) و نام پیوند بین اتم ها ، پیوند یونی است ، مانند NaCl.
- ترکیب مولکولی : در این ترکیب اتم ها باهم مبادله ی الکترون ندارند ، بلکه الکترون ها را باهم به اشتراک می گذارند ، نام پیوند بین اتمها ، پیوند کووالانسی است ، مانند آب ، اتانول ، آمونیاک ، اتیلن گلیکول و … .
پیوند یونی :
در این پیوند اتم برای رسیدن به آرایش الکترونی گازهای نجیب (پایدار شدن) تلاش می کند و معمولا تولید یون به صورت مثبت یا منفی خواهد بود زیرا در آنها اتم جابجا میشود و معمولا بین فلزات (که تمایل به از دست دادن الکترون (یون مثبت)دارند) و نافلزات (که تمایل به از گرفتن الکترون (یون منفی)دارند) اتفاق می افتد.
برای مثال به ترکیب یونی NaCl (سدیم کلرید یا نمک طعام) دقت کنید ، Na (سدیم) دارای عدد اتمی ۱۱ تمایل به از دست دادن الکترون دارد و Cl (کلر) با عدد اتمی ۱۷ تمایل به گرفتن الکترون دارد ، در تصویر زیر کامل توضیح داده شده است.
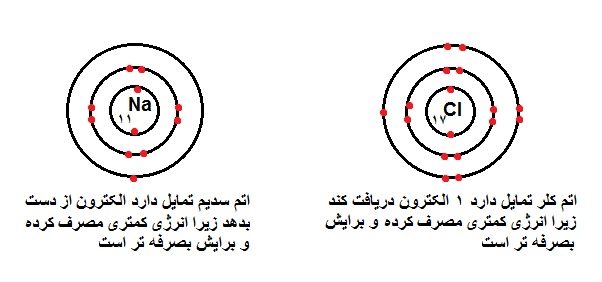
ویژگی ها :
- همیشه جامد هستند.
- ترکیب شبکه ای آنها (شکل هندسی) منظم است.
- دمای آنها بالا است.
- نیروی بین اتم ها در این پیوند قوی است زیرا باهم الکترون جابجا کرده و پایدار شده اند.
- محلول آنها باهم رسانای الکتریکی هستند.
- در ترکیب ، آنها خنثی می شوند.
پیوند کووالانسی :
اتم ها در این نوع ترکیب هم دوست دارند به آرایش الکترونی گازهای نجیب (پایدار برسند) همین طور الکترون ها جابجا نمی شوند و فقط به اشتراک گذاشته می شوند و معمولا در نافلزها اتفاق می افتد. در شکل زیر کاملتر توضیح داده شده است.
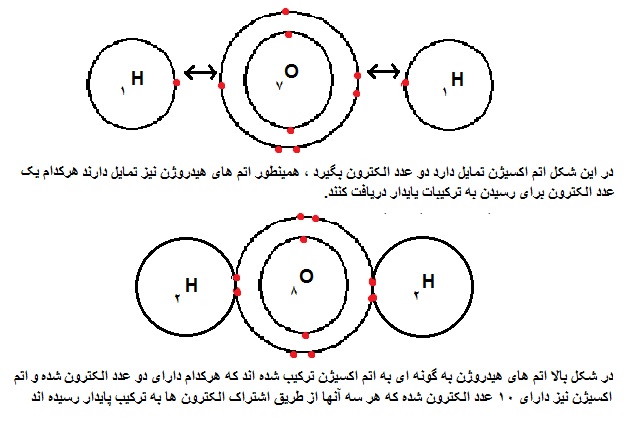
ویژگی ها:
- دارای نقطه ذوب و جوش پایینی هستند زیرا پیوند بین آنها سست و ضعیف است.
- دارای جاذبه مولکولی ضعیف نیز می باشند.
- رسانای جریان برق نیستند. (نارسانا) ، زیرا محلول آن تولید یون نمی کند (یونها هستند که رسانای جریان الکتریکی اند) و الکترونی ردوبدل نشده و فقط به اشتراک گذاشته شده است.
هیدروکربنها:
مولکولهایی که از کربن و هیدروژن تشکیل شده اند ، عدد اتمی کربن ۶ است و هیدروژن ۱ ، هر اتم در لایه اول خود دارای ظرفیت ۲ الکترون و در لایه دوم خود ظرفیت ۸ عدد الکترون و در لایه های بالایی هم ظرفیت ۸ عدد الکترون را دارد ، بنابراین اتم کربن با عدد اتمی ۶ دارای ۲ لایه است که لایه اول دارای ۲ عدد الکترون و لایه دوم دارای ۴ عدد الکترون می باشد ، حالا این اتم برای رسیدن به ترکیب پایدار به ۴ عدد الکترون دیگر در لایه دوم خود احتیاج دارد که این کمبود را می تواند از طریق پیوند کووالانسی و یا یونی جبران کند.
حالا به پیوند های زیر دقت کنید:
| تعداد اتم | ۲C , 2H | ۲C , 4H | ۲C , 6H |
| فرمول مولکولی | C2H2 | C2H4 | C2H6 |
| نمایش مولکولی | 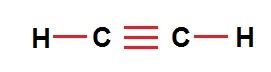 | 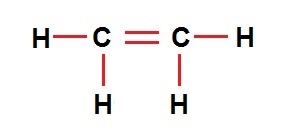 | 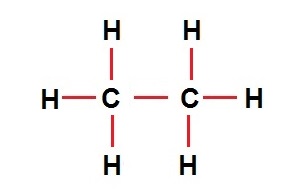 |
گفتیم هر اتم کربن دارای ۲ عدد الکترون در لایه اول و چهار عدد الکترون در لایه دوم است ، یعنی اتم کربن به چهار عدد الکترون دیگر احتیاج دارد بنابراین می تواند چهار تا چهار ترکیب دیگر هم انجام دهد
.






مهدی
سوالی دارم آیا امکان دارد که یه مولکول را به اتم های جدا از هم تبدیل نمود وسوال دومم اینکه آیا اتم هایی وجود دارند که برای پیوند با هم در شرایطی خاص با مولکول بسازند